Le Groupement de recherche (GDR) Organoïdes réunit la communauté scientifique française autour du développement et de l’étude des modèles biologiques du même nom. Nous avons rencontré Vincent Flacher, directeur du GDR, et Maxime Mahé, membre du comité de pilotage du GDR. Ils déroulent avec nous le fil de discussion autour des modèles organoïdes, de leur conception à leur utilisation, en passant par les enjeux de demain.
Ce qu'il faut retenir
- Les organoïdes reproduisent partiellement l'architecture et les fonctions d'un organe, malgré des réserves sur la reproductibilité des résultats ;
- Les organoïdes sont une avancée prometteuse pour la médecine personnalisée ;
- Les organoïdes peuvent être associés entre eux ou avec des puces pour modéliser des structures plus complexes.

Quelles sont vos fonctions et vos spécialités de recherche ?
Maxime Mahé : Je suis chargé de recherche à l’Inserm. Mon groupe est spécialisé dans l’étude du développement et de la physiologie intestinale humaine en condition normale et au cours des maladies.
Vincent Flacher : Je suis immunologiste au CNRS. Je m’intéresse particulièrement à la peau, cette barrière qui nous protège physiquement et immunologiquement lors de ses rencontres avec des pathogènes extérieurs.
Vous êtes tous les deux impliqués dans le comité de pilotage du GDR organoïdes. Qu’est-ce qu’un organoïde ?
M. M : Un organoïde est une structure multicellulaire en trois dimensions qui mime une partie de l’architecture d’un organe cible et certaines de ses fonctions physiologiques. Pour aboutir à un organoïde, il y a deux façons de procéder. Dans la première, nous utilisons des cellules déjà compétentes, c’est-à-dire des cellules souches adultes ou des progéniteurs de tissus spécifiques. Celles-ci sont prélevées chez un donneur et mises en culture. Ces cellules s’auto-organisent ensuite pour former une structure de l’organe cible. Par exemple, nous prélevons des cellules souches adultes de l’intestin afin de reformer une partie de l’organe intestinal.
La seconde façon de faire consiste à diriger la différenciation des cellules, donc à orienter des cellules non spécifiées vers un organe donné. On utilise alors des cellules souches pluripotentes qui ont la capacité de donner quasiment toutes les cellules de l’organisme. Selon les techniques utilisées et les organes visés, la taille des organoïdes oscille entre une centaine de micromètres à plusieurs millimètres. Ils ne sont pas du tout comparables à un organe réel autant en termes de taille que de physiologie et d’architecture.
Les organoïdes ne sont pas du tout comparables à un organe réel
autant en termes de taille que de physiologie et d’architecture.
Comment utilisez-vous les organoïdes dans vos recherches ? Utilisez-vous également des modèles animaux ?
M. M : L’objectif de mon équipe est de comprendre les aspects fondamentaux de la mise en place du tube digestif ainsi que les pathologies digestives. Nous utilisons pour cela des organoïdes qui miment différentes fonctions de l’intestin depuis une dizaine d’années.
V. F : Je ne travaille pas à proprement parler sur des organoïdes, mais plutôt sur des modèles tissulaires 3D. Mon objectif est de complexifier ces modèles de peau en leur ajoutant un système immunitaire et des neurones sensoriels qui sont notamment connus pour interagir dans certaines maladies comme la dermatite atopique (une maladie de peau commune). Mes recherches sont donc à la croisée des chemins entre les personnes qui font des organoïdes et la volonté actuelle d’enrichir ces structures en leur ajoutant d’autres composantes qui font partie intégrante d’un organe donné. Afin de nous assurer que nos modèles respectent la physiologie, nous travaillons également chez la souris et sur des explants chirurgicaux de peau humaine.
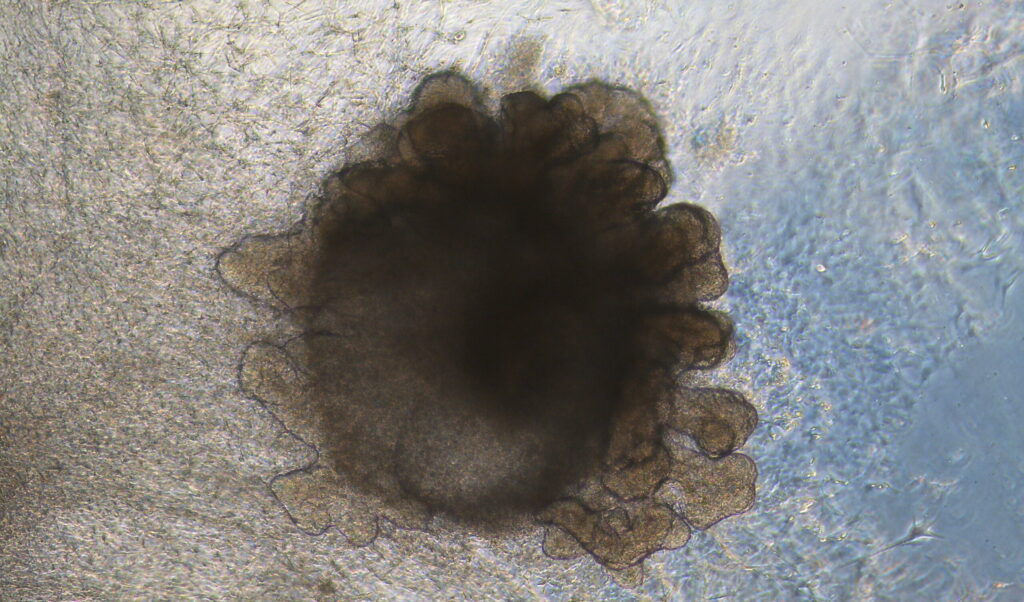
Quels sont les différents types d’organoïdes ?
M. M : Les méthodes mises en place permettent de réaliser des organoïdes de plusieurs organes : intestin, foie, rein, poumon, rétine, cerveau, etc. Nous parlons aussi de plus en plus d’assembloïdes. Ces derniers consistent à réunir des organoïdes qui miment différentes fonctions d’un même organe ou d’un système physiologique et à les faire interagir. Le cas le plus connu est un assembloïde cérébral qui réunit des organoïdes de différentes régions du cerveau. Dans mon équipe, nous commençons à travailler sur des assembloïdes du système digestif combinant des fonctions du pancréas, de l’intestin et du foie. Bien évidemment, nous sommes encore loin d’une représentation intégrée, comme dans le cas d’un modèle animal.
V. F : Il y a également des organoïdes reproduisant des pathologies. Par exemple, les tumoroïdes sont créés à partir d’une tumeur. Ils sont envisagés pour faire de la médecine personnalisée. On extrait alors une petite partie de la tumeur d’un patient que l’on cultive en laboratoire pour tester ensuite des traitements adaptés au patient. Les tumoroïdes servent aussi à l’identification plus large d’agents thérapeutiques qui agiraient sur une grande variété de tumeurs. Cela reste, pour le moment, un outil de recherche fondamentale et préclinique.
M. M : Des organoïdes dérivés de pathologies existent aussi de manière assez avancée sur des maladies rares, dont la mucoviscidose. À partir de prélèvements naso-pharyngés, les chercheurs font des organoïdes pulmonaires qui permettent de tester des potentiels médicaments. Ils ciblent le canal CFTR qui est défaillant chez ces patients.
Un GDR (Groupement de Recherche) vise à réunir la communauté scientifique française autour d’une thématique ou problématique commune en lui offrant une plateforme d’échange et ainsi stimuler les collaborations et la production de connaissances. Le GDR organoïdes a été créé en 2021. Il réunit une centaine d’équipes de recherche à travers la France, travaillant sur une liste d’organes qui couvre la totalité du corps humain. Les spécialités y sont également larges : organoïdes humains et animaux, tumoroïdes, ingénierie tissulaire, organes sur puce, etc.
Depuis sa création, ce réseau a soutenu différents congrès, organisé des écoles thématiques et des rencontres scientifiques. Il contribue aussi à la formation des étudiants et des personnels, notamment grâce à ses écoles thématiques. L’année 2024 est annonciatrice d’une nouvelle dynamique pour cette communauté avec le lancement côté recherche d’un Programme et équipements prioritaires de recherche, le PEPR MED-OOC (porté par le CEA, le CNRS et l’Inserm). Au niveau industriel, un comité de structuration de filières a mis en évidence l’importance de développer une filière sur les organoïdes et organes sur puce en France.
Qu’en est-il des perspectives apportées par les organoïdes sur puce ?
M. M : Cela fait très longtemps que nous essayons de connecter les organes ensemble, mais jusqu’à présent, nous le faisions d’une manière primitive. C’est là qu’interviennent les organoïdes sur puce dont l’idée est d’essayer de reproduire un système plus intégré capable de mimer des fonctions biologiques plus complexes.
V. F : Ce support de culture est intéressant, car il permet de contrôler l’environnement physico-chimique des cellules en agissant, via des systèmes de microcanaux, sur les apports en éléments nutritifs dans le milieu de culture, par exemple. Il facilite aussi le suivi des fonctions biologiques étudiées. Ces technologies sont prometteuses, car elles permettent de se rapprocher d’autres domaines pour faire avancer des questions fondamentales en biologie. Nous sommes cependant encore loin de pouvoir représenter toute la complexité du corps humain et ce n’est pas un objectif réaliste non plus. Chaque organe a plusieurs fonctions qui interagissent souvent entre elles. Non seulement nous ne savons pas encore reproduire l’intégralité de ces fonctions individuellement, mais nous ne savons probablement pas encore tout sur les capacités de nos organes non plus.
Ces technologies sont prometteuses mais nous sommes encore
loin de pouvoir représenter toute la complexité du corps humain.
Un verrou souvent mis en avant concernant les organoïdes est la reproductibilité des résultats. Pouvez-vous nous expliquer?
M. M : Les organoïdes sont des structures complexes dont le mode de production n’est pas toujours standardisé. Le principe d’auto-organisation des cellules, par exemple, apporte une part d’aléatoire qui fait que les organoïdes, inter-individuellement, sont différents. Il y a donc une problématique de recherche plus large : comment faire un modèle organoïde robuste ?
V. F : Standardiser, c’est aussi se mettre d’accord sur ce qu’on mesure pour qualifier les organoïdes. Il s’agit d’un des enjeux du projet européen HYBRIDA auquel participent plusieurs membres du comité de pilotage du GDR et qui veut apporter un cadre réglementaire aux organoïdes. L’enjeu est de répondre à cette question : pourquoi dit-on que l’organoïde d’un laboratoire A est identique à celui d’un laboratoire B ? Nous devons nous mettre d’accord sur les paramètres qui définissent les organoïdes.
Plusieurs industriels proposent également des kits de fabrication en fournissant différents types de cellules, du milieu de culture assurant une bonne croissance des cellules, des supports adéquats… Pour certains types d’organoïdes, on peut arriver à des résultats satisfaisants. Cela montre que les méthodes d’obtention des organoïdes deviennent de plus en plus robustes, aidant la science à avancer dans ce domaine.
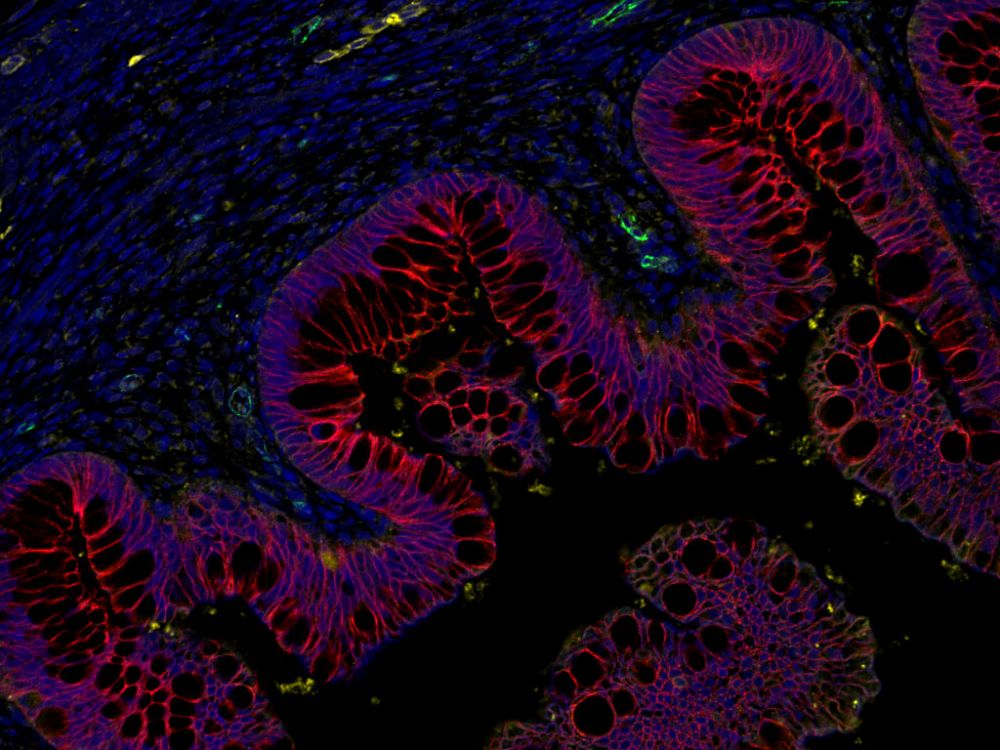
La capacité de prédiction des organoïdes par rapport à ce qui est établi
chez les modèles in vivo en recherche clinique reste une question ouverte.
Comment les modèles organoïdes se positionnent-ils dans le paysage des modèles biologiques ?
M. M : Les organoïdes ont bien sûr ouverts de nouvelles portes. Il n’était pas possible d’étudier certaines pathologies rares sur des modèles animaux, par exemple. Les organoïdes offrent aussi un accès à de nouvelles connaissances, comme sur le développement du cerveau humain qui est très spécifique. Nous sommes encore dans une approche exploratoire qui vise à définir ces modèles et ce qu’ils vont nous apporter.
V. F: Les organoïdes offrent une certaine polyvalence en servant de support à des intérêts de recherche fondamentale et à des fins plus applicatives en médecine. Mais de nombreux tests sur animaux sont établis depuis longtemps et mieux caractérisés. Dans une démarche des 3R, les organoïdes nous permettent déjà de participer à la réduction et au raffinement des expériences. Toutefois, il faut rester modestes et admettre qu’ils ne peuvent pas remplacer le modèle animal aujourd’hui. On ne peut pas axer la science sur une intuition, il manque encore des preuves formelles des bénéfices apportés par les organoïdes.
Dans les années à venir, nous devrons donc fournir de gros efforts pour prouver que ces modèles sont à la hauteur des espoirs qui leur sont associés. Nous savons qu’à partir de modèles précliniques, incluant les tests sur l’animal, il y a un certain nombre d’échecs dans les premières ou deuxièmes phases d’essais cliniques. Nous espérons arriver à de meilleures prédictions chez l’humain grâce aux modèles organoïdes. Mais la capacité de prédiction des organoïdes par rapport à ce qui est établi chez les modèles in vivo en recherche clinique reste une question ouverte.
Dans une démarche des 3R, les organoïdes nous permettent déjà de participer
à la réduction et au raffinement des expériences.
Quelles sont les grandes questions et enjeux auxquels la communauté scientifique doit répondre pour faire avancer ces modèles ?
M. M : La première est d’accroître les connaissances fondamentales de l’objet organoïde en tant que tel. Par exemple, nous développons des structures avec des fonctions biologiques majeures, mais nous n’allons pas dans la caractérisation complète de ces modèles. C’est le problème de standardisation dont on vient de parler.
La seconde est de trouver d’autres moyens de conception. Est-ce que d’autres technologies vont nous apporter des résultats plus reproductibles ? On peut penser à de l’automatisation, à des approches d’impression 3D, par exemple, mais aussi à des méthodes de contrôle de l’organisation cellulaire. C’est là qu’interviennent les approches liées à la microfluidique avec les organes et organoïdes sur puce en cours de développement. Enfin, la structuration en 3D permet d’observer des fonctions biologiques difficilement modélisable en 2D. Cependant l’analyse d’un écosystème en 3D est moins évidente qu’en 2D, car jusqu’à présent, la majorité des techniques ont été développées autour de modèles bidimensionnels. Nous devons aujourd’hui innover afin d’améliorer notre capacité d’analyse.
V. F: Plus spécifiquement, en France, les hôpitaux disposent de centres de ressources biologiques dans lesquels les organoïdes peuvent être conservés. Nous aimerions que ces ressources puissent profiter à l’ensemble de la recherche fondamentale, clinique et industrielle française. Dans le cadre du GDR, nous sommes en train de mettre en place un catalogue répertoriant tous les organoïdes et les cellules disponibles dans ces centres (projet RIBBON – Réseau national de plateformes de production et de biobanques d’organoïdes). Autrement dit, nous voulons faciliter un partage de ressources qui se ferait de manière éthique, afin d’éviter une marchandisation de ces éléments tout en faisant avancer la recherche.
Nous voulons faciliter un partage de ressources qui se ferait de manière éthique, afin d’éviter une marchandisation de ces éléments tout en faisant avancer la recherche.
Qu’en est-il justement des questions éthiques associées aux organoïdes ?
V. F : Les organoïdes soulèvent des questions éthiques nouvelles qui sont abordées dans le cadre du GDR. La question du consentement du donneur en est une. C’est un enjeu que de tenir compte des droits des patients et de leur volonté, ou non, d’utiliser leurs cellules pour telle ou telle chose.
M. M : Plusieurs questions émergentes font leur apparition dans les médias : les organoïdes sont-ils des organes ? La réponse est non. Il y a aussi eu un questionnement autour des organoïdes cérébraux : sont-ils doués d’une conscience ? Encore une fois, il est faux de penser que cela serait le cas. Ces débats éthiques restent importants, car ils nous permettent de qualifier les organoïdes d’un point de vue moral. Ils nous aident à définir jusqu’où on peut aller avec ces modèles.
Propos recueillis par Anaïs Culot pour le Gircor
Quelques chiffres
- Moins d'une semaine : durée minimale pour faire pousser un organoïde dérivé d'une cellule souche adulte
- Plusieurs mois : durée de vie maximale d'un organoïde
- 150$ : coût d'un organoïde classique
- Entre 0,1 et 0,4 mm : taille d'un organoïde standard