En 2023, un patient paraplégique marchait en contrôlant ses mouvements par la pensée. Quatre ans plus tôt, une personne tétraplégique parvenait à se mouvoir à l’aide d’un exosquelette. Au cœur de ces deux avancées majeures : une interface cerveau-machine baptisée WIMAGINE développée par les chercheurs et ingénieurs de la plateforme Clinatec du CEA-Leti à Grenoble. Guillaume Charvet, en charge du programme Interface Cerveau-Machine, et David Ratel, en charge des études biologiques autour de l’implant, retracent l’historique de ce dispositif, des premières idées aux essais cliniques actuels.
À retenir
- En 2023, l'interface cerveau-machine WIMAGINE a permis à un patient paraplégique de marcher par la pensée, marquant une avancée majeure
- Le développement de WIMAGINE a débuté en 2008 avec des essais précliniques successifs sur des rongeurs et des primates non humains pour valider la biocompatibilité.
- Les essais cliniques chez l'humain, débutés en 2017, ont abouti à des résultats révolutionnaires, montrant la nécessité des modèles animaux dans le processus de développement d’interfaces cerveau-machine.
Comment fonctionne l’implant WIMAGINE et quelles sont les origines de son développement ?
Guillaume Charvet : L’implant WIMAGINE capte, transmet de manière sans fil l’activité électrique cérébrale mesurée au niveau du cortex moteur afin de les décoder en temps réel et d’en extraire les intentions de mouvement du patient. Il est placé sous la boîte crânienne au contact de la dure mère, une membrane fibreuse qui entoure notre cerveau. Ce dispositif est au cœur d’essais cliniques chez l’humain depuis 2017 et est notamment impliqué dans des résultats ayant permis à une personne tétraplégique de contrôler un exosquelette et une personne paraplégique de marcher.
L’idée de développer cette interface cerveau-machine remonte à 2008 lors de la création du centre de recherche biomédicale Clinatec du CEA. À l’époque, il y avait peu de résultats dans la littérature scientifique internationale sur des systèmes mesurant efficacement l’activité du cortex. Des chercheurs de l’Université de Brown aux États-Unis avaient mis au point une matrice d’électrodes implantée dans les premières couches du cortex qui était très invasives pour le cerveau et présentait des limites. Nous voulions donc montrer qu’en plaçant simplement des électrodes à la surface du cortex, et non plus à l’intérieur, il était possible d’obtenir les mêmes capacités de contrôle sur des bras robotisés ou des exosquelettes, par exemple.
Dès lors, nous avons mené de front différents développements afin de répondre à trois questions essentielles : quel type de signal capter ? Comment le décoder ? Et quel assemblage mettre en œuvre afin d’assurer une technologie biocompatible qui sera acceptée par le corps ? Des essais précliniques sur des rongeurs, puis sur des primates non humains et des brebis ont permis de répondre à ces enjeux et de dérisquer la future implantation chez l’humain.
L’idée de développer cette interface cerveau-machine remonte à 2008.
Comment avez-vous mené les recherches sur l’aspect biocompatible des futurs implants ?
David Ratel : Avant toute implantation chez l’animal, nous devions concevoir un dispositif préclinique qui soit le mieux toléré possible par le tissu cérébral. L’objectif étant de préserver l’animal et d’éviter les réactions tissulaires susceptibles de bloquer l’enregistrement des données. La particularité de notre technologie est qu’elle est destinée à une implantation à vie. Ce caractère chronique est déterminant, car certains matériaux biocompatibles ne sont pas qualifiés pour une aussi longue temporalité.
Par ailleurs, il s’agissait de s’assurer que l’assemblage des matériaux au sein du dispositif n’aboutissait pas à la libération de résidus potentiellement toxiques. En ce sens, nous avons eu recours à des modèles cellulaires pour réduire le nombre d’animaux utilisés. De là, nous avons pu valider le caractère implantable de notre dispositif préclinique. Sans quoi, les matériaux auraient été modifiés et étudiés à nouveau.
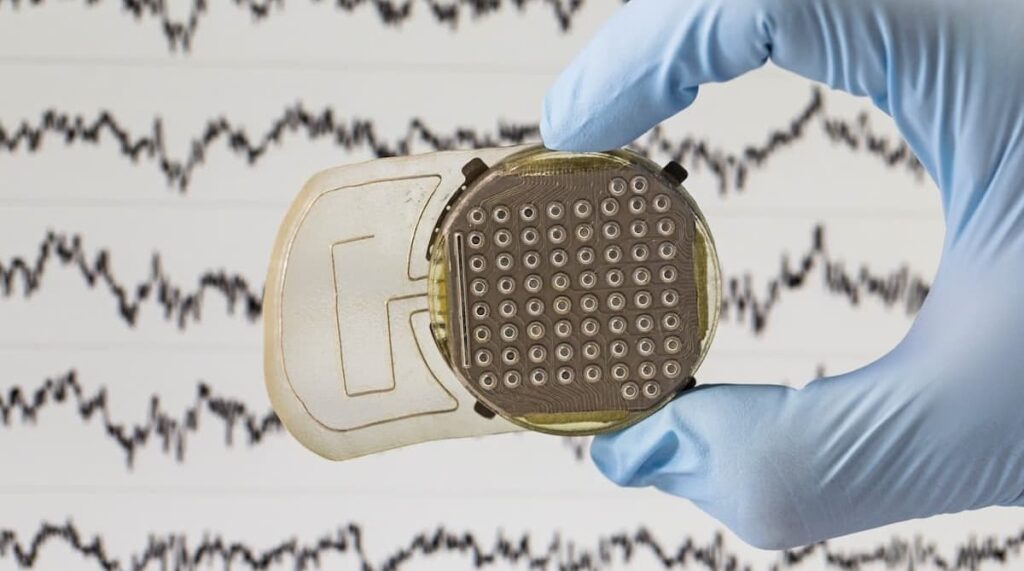
Des premiers travaux précliniques ont d’abord été menés chez le rat. Quels étaient leurs objectifs ?
D. R. : Dans la continuité des essais sur la biocompatibilité, l’étude chez le rat a validé la tolérance de notre dispositif au niveau du cerveau. Cela a permis de prévenir des risques tels que des phénomènes neuroinflammatoires – c’est-à-dire une réponse immunitaire qui protège notre cerveau contre des agressions ; mais aussi le risque de pertes de neurones ou encore une rupture de la barrière hémato-encéphalique qui sert à réguler le milieu tissulaire cérébral.
De plus, l’objectif principal des essais sur le rat était de recueillir des signaux biologiques électriques du cortex dans le but de développer des algorithmes de détection d’intention de mouvement. Au cours des expériences, l’animal devait appuyer sur une pédale en vue d’obtenir une récompense. Cela nous a permis d’extraire une signature du cortex cérébral du rat impliquée dans ce mouvement. Mais aussi de développer les bons algorithmes de traitement des données captées.
L'objectif principal des essais sur le rat était de développer
des algorithmes de détection d’intention de mouvement.
Vous avez ensuite mené une deuxième série d’essais chez le macaque. Comment cette phase a contribué à l’avancement de l’implant vers sa qualification ?
D. R. : Aller chez le primate a eu plusieurs intérêts. Nous avons développé un implant à l’échelle un demi qui nous a permis de couvrir l’intégralité du cortex moteur et de cartographier les zones où le signal était le plus informatif. Cette étape n’était pas possible chez le rat qui a un cortex de quelques centaines de micromètres carrés de surface. Le dispositif utilisé chez le primate était donc représentatif du dispositif clinique qui a été implanté chez l’humain. Il intégrait l’ensemble des matériaux en contact avec la dure-mère dans le but d’évaluer la biocompatibilité in vivo et la tolérance locale.
Ces études ont aussi aidé à choisir le site d’implantation chez l’Homme. Nous avons opté pour une localisation extra-durale, c’est-à-dire entre la dure-mère et la boîte crânienne, qui permettait d’obtenir des signaux de bonne qualité et de réduire le risque infectieux. Enfin, les essais chez le macaque ont servi à tester la robustesse des algorithmes de détection de signatures d’intention de mouvement avec des protocoles plus proches du dispositif humain.
Le dispositif utilisé chez le primate est
représentatif de celui implanté chez l’humain.
Quelles étapes ont suivi jusqu’à la publication des premiers résultats chez l’humain en 2019 ?
G. C. : Le dispositif final, identique à celui destiné à l’humain, a été implanté en dernier lieu chez la brebis. Cela a permis de valider le fonctionnement du système global et son utilisation sur plusieurs mois. L’ensemble des essais sur les animaux et les modèles in vitro nous ont permis d’obtenir les autorisations à la fin de l’année 2016 de la part des autorités réglementaires pour des essais chez l’Homme. Un premier patient tétraplégique a été implanté le 21 juin 2017, avec des premiers résultats publiés en 2019 dans la revue Lancet Neurology (Benabid et al., 2019).
Grâce au dispositif WIMAGINE et aux algorithmes associés, le patient a été capable de contrôler les quatre membres d’un exosquelette développé par les équipes du CEA. C’était une première mondiale ! Il a fallu deux années pour entraîner le patient sur l’exosquelette et adapter les algorithmes aux nouvelles données. L’exosquelette n’avait, cependant, pas vocation à être utilisé à domicile. Il visait seulement à valider le concept clinique.
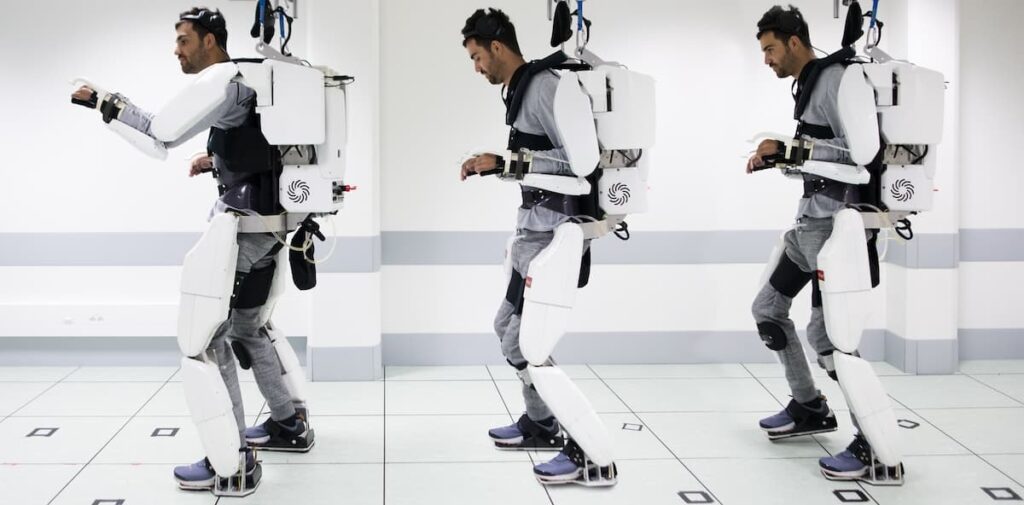
Toujours en 2019, vous démarrez une collaboration avec une équipe suisse qui aboutit à un nouveau résultat majeur en 2023. Racontez-nous.
G. C. : En parallèle de nos travaux, une équipe suisse de l’École polytechnique fédérale de Lausanne (EPFL) et du Centre hospitalier universitaire de Lausanne (CHUV) était parvenue à une démonstration clinique d’un dispositif capable de stimuler une région spécifique de la moelle épinière pour générer des mouvements de pas. Mais la stimulation était contrôlée de manière externe. L’idée est donc venue de combiner nos technologies afin de créer un pont digital entre le cerveau et la moelle épinière. Ces travaux ont commencé en 2019 avec l’obtention d’autorisations pour la mise en place d’un nouvel essai clinique et une implantation en 2021. Les résultats présentés en mai 2023 dans la revue Nature (Lorach et al., 2023) sont un jalon important du domaine des interfaces cerveau-machine, car le patient a pu utiliser cette technologie pour marcher quelques heures par jour en contrôlant ses mouvements par la pensée.
Ce résultat arrive 15 ans après les premiers développements, l’aventure est-elle pour autant terminée ?
G. C. : Loin de là ! Cela peut paraître long, mais il faut garder en tête qu’on est parti d’une idée et non de résultats préexistants. Tout était donc à faire, des circuits intégrés, à l’élaboration des dispositifs et leur validation préclinique, jusqu’à l’entraînement des patients, etc. Les essais cliniques chez l’humain durent depuis 6 ans, mais ils n’ont été menés à chaque fois qu’avec un seul patient. La prochaine étape sera donc de reproduire les résultats obtenus avec d’autres patients.
Nous allons également étendre les indications cliniques de cette technologie. En ce sens, un nouvel essai clinique vient de démarrer afin de permettre à des patients tétraplégiques de contrôler le mouvement de leurs bras avec une interface cerveau-moelle épinière au niveau des vertèbres cervicales. Enfin, il faut encore réduire la taille de la technologie. Le décodage des algorithmes se fait actuellement sur un ordinateur. L’objectif serait de passer à un simple système qui s’accrocherait à la ceinture, voire qui tiendrait sur une puce électronique afin de permettre l’usage de cette technologie dans le cadre de la vie quotidienne.

Est-ce que d’autres approches et notamment d’autres modèles que les animaux permettraient d’atteindre ces résultats aujourd’hui ?
D. R. : L’expérimentation chez le rat était nécessaire pour avoir l’information pertinente de fonctionnement des algorithmes qui est la pierre angulaire de l’implant. Elle le serait tout autant aujourd’hui. De même, notre dispositif n’aurait jamais pu entrer dans une phase d’essai clinique chez l’humain sans les essais sur les macaques et l’implantation chez la brebis. Nous revendiquons donc entièrement cette démarche qui combine des modèles in vitro et in vivo et surtout qui suit un ordre d’étape bien défini, tout en suivant la règle des 3R.
Avec le recul, si nous devions réaliser la même étude aujourd’hui, on suivrait les mêmes étapes, sur les mêmes modèles. Il n’existe pas de méthodes ou de modèles alternatifs qui nous permettraient de réitérer ce succès et l’impact positif de l’implant WIMAGINE sur la vie des patients.
Propos recueillis par Anaïs Culot pour le Gircor
Quelques chiffres
- 15 ans, c'est le temps qu'il aura fallu pour faire remarcher un premier paraplégique grâce à l'interface cerveau machine mise au point par Clinatec
- 3 modèles animaux pour réaliser les essais précliniques : rongeur, brebis et primate non humain
- 25 brevets couvrent la technologie WIMAGINE
Publications
- Lorach, H., Galvez, A., Spagnolo, V., Martel, F., Karakas, S., Intering, N., ... Charvet G., Bloch J. & Courtine, G. (2023). Walking naturally after spinal cord injury using a brain–spine interface. Nature, 1-8
- Benabid, A. L., Costecalde, T., Eliseyev, A., Charvet, G., Verney, A., Karakas, S., ... & Schaeffer, M. C. (2019). An exoskeleton controlled by an epidural wireless brain–machine interface in a tetraplegic patient: a proof-of-concept demonstration. The Lancet Neurology, 18(12), 1112-1122.
- Sauter-Starace, F., Ratel, D., Cretallaz, C., Foerster, M., Lambert, A., Gaude, C, T. Costecalde, S. Bonnet, G. Charvet., ... N. Torres-Martinez (2019). Long-term sheep implantation of WIMAGINE®, a wireless 64-channels electrocorticogram recorder. Frontiers in neuroscience,
- Costecalde, T., Aksenova, T., Torres-Martinez, N., Eliseyev, A., Mestais, C., Moro, C., & Benabid, A. L. (2018). A long-term BCI study with ECoG recordings in freely moving rats. Neuromodulation: Technology at the Neural Interface, 21(2), 149-159.
- Mestais, C. S., Charvet, G., Sauter-Starace, F., Foerster, M., Ratel, D., & Benabid, A. L. (2014). WIMAGINE: Wireless 64-channel ECoG recording implant for long term clinical applications. IEEE transactions on neural systems and rehabilitation engineering, 23(1), 10-21.

