
Le poisson zèbre aide la recherche à percer les mystères de la génétique sous-jacente à l’autisme. Ce poisson tropical, qui ne dépasse pas cinq centimètres à l’âge adulte, est, à première vue, bien éloigné de l’être humain. Il est pourtant un modèle de choix dans l’étude de la génétique et des mutations de l’ADN. Pour en savoir plus, le Gircor a échangé avec Christelle Golzio, chercheuse Inserm à l’Institut de génétique et de biologie moléculaire et cellulaire (IGBMC – CNRS/Inserm/Université de Strasbourg) et spécialiste de l’étude des variations génétiques dans l’autisme.
Dans quel contexte s’intègrent vos recherches et quel est leur objectif ?
Christelle Golzio : Lorsqu’un enfant présente des troubles autistiques ou une possible atteinte des fonctions cognitives, le clinicien demande un séquençage de son ADN afin d’en déterminer des causes génétiques. Les technologies de séquençage identifient très bien les variations de l’ADN, il peut s’agir de variations ponctuelles impliquant une base de l’ADN ou des réarrangements de grande taille impliquant des larges fragments de chromosomes. Les cliniciens classifient ces variations selon la causalité probable de la variation génétique dans l’apparition de la maladie du patient. Dans certains cas, l’interprétation de ces variations identifiées reste difficile et c’est, dans ce cadre-là, qu’interviennent les recherches menées dans mon laboratoire.
Nous utilisons des modèles animaux, dont le poisson zèbre, afin de modéliser les variants génétiques repérés chez les patients et de déterminer s’ils ont un effet délétère sur la fonction du gène ou non. Nos travaux visent à la fois à identifier des gènes responsables de traits autistiques et à caractériser en détail comment ils participent au développement du cerveau et d’autres organes lors du développement fœtal.
En apparence, le modèle de poisson zèbre est assez éloigné de l’humain. En quoi est-il particulièrement adapté aux questions que vous vous posez sur l’autisme ?
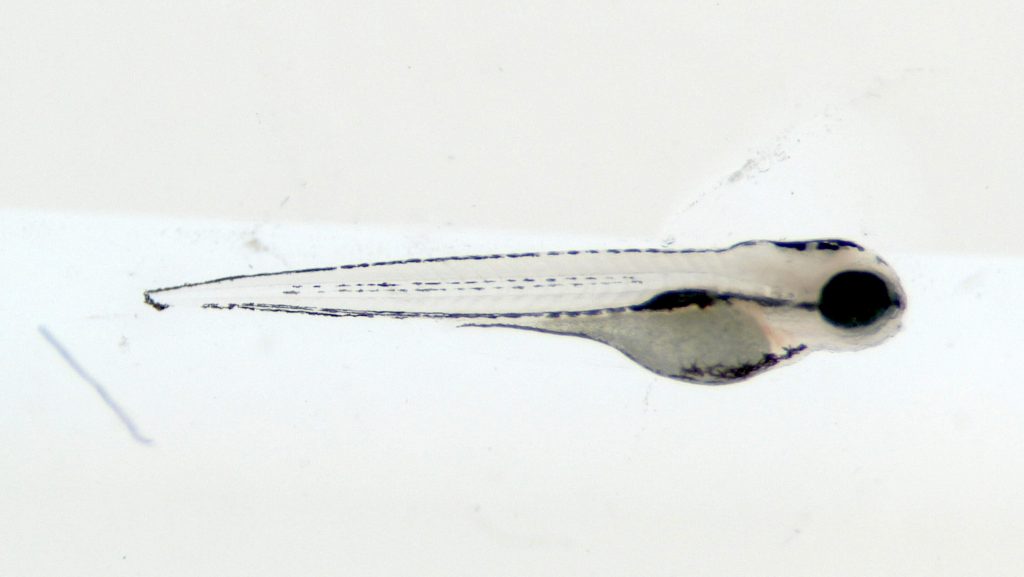
CG : Ce modèle présente plusieurs avantages. Le principal est que 70 % des gènes sont conservés entre le poisson zèbre et l’humain, ce qui est très important ! Cela nous permet de faire des modélisations de pathologies humaines sur un organisme entier et donc d’étudier de nombreux phénotypes, c’est-à-dire les traits observables d’un organisme qu’ils soient anatomiques, physiologiques, moléculaires ou comportementaux.
Un autre avantage est que la croissance de ce poisson se fait à l’extérieur du corps de la femelle. Celle-ci produit des centaines d’œufs par ponte qui sont fertilisés dans l’eau par le sperme du mâle. Les observations des stades de développement larvaire, en particulier la formation du cerveau, se font donc ex utero. La transparence des larves facilite, à leur tour, l’utilisation de méthodes d’imagerie non-invasive. De plus, le développement du poisson zèbre est très rapide. À cinq jours de vie, les larves ont déjà un système nerveux complètement fonctionnel et la majorité de leurs organes sont formés.
Quelles manifestations de l’autisme étudiez-vous en particulier sur ce modèle ?
CG : Nous suivons plusieurs manifestations de l’autisme à commencer par l’impact de mutations sur le développement du cerveau. Pour cela, nous comparons des larves modifiées génétiquement à des larves de poisson zèbre « sauvage ». Nos observations par imagerie suivent le devenir de progéniteurs neuronaux, c’est-à-dire les cellules à l’origine de la formation des neurones. L’objectif est de s’assurer qu’elles se divisent correctement, qu’elles n’entrent pas en mort cellulaire, qu’elles se différencient bien en neurones, etc. Nous suivons également la distribution des neurones dans les différentes régions du cerveau. Cela peut paraître surprenant, mais le poisson zèbre possède un cerveau assez organisé. Bien que le cerveau du poisson zèbre ne présente pas de gyration comme chez l’humain, il présente toutes les structures cérébrales essentielles pour la motricité, l’identification de signaux sensoriels, l’apprentissage et la mémoire, qui sont équivalentes à celles de l’humain.
Nous réalisons également des tests de comportement sur la larve ou le jeune poisson adulte. En effet, cet animal vit en banc, il est donc de nature très sociable. Au cours de nos expériences, nous nous intéressons à l’organisation sociale dans les aquariums : est-ce que les bancs s’organisent normalement ? Y a-t-il des défauts de sociabilité ou la présence d’agressivité ? Ces recherches servent à caractériser les conséquences de mutations de gènes d’autisme sur le plan cognitif.
Le poisson zèbre permet-il également d’étudier les co-morbidités de l’autisme, c’est-à-dire les atteintes sur d’autres organes que le cerveau ?
CG : Oui, complètement. Entre 70 et 80 % des formes d’autisme sont dites syndromiques, ce qui signifie qu’il y a des atteintes sur d’autres organes. On observe en particulier des effets sur le système nerveux entérique qui entraîne des troubles gastro-intestinaux. L’intestin est considéré comme notre deuxième « cerveau », car il dispose lui aussi des neurones. Grâce au poisson zèbre, nous étudions justement comment des mutations génétiques affectent la façon dont les neurones se forment et colonisent le système digestif.
Une de nos expériences consiste, par exemple, à faire ingérer des billes fluorescentes à des larves et de les suivre le long du tractus intestinal. L’idée est de détecter d’éventuels blocages synonymes d’une diminution de la motilité de l’intestin qui se manifeste par des phases de constipation sévères, des diarrhées, etc.
Une fois que l’impact fonctionnel des gènes est démontré chez l’animal, quelle est l’étape suivante ?
CG : Une fois le gène et son impact identifiés, on va vouloir corriger certains phénotypes. À nouveau, le poisson zèbre est un très bon modèle, car il nous permet de tester rapidement l’effet de plusieurs dizaines de drogues en même temps. Celles-ci peuvent être directement dissoutes dans l’eau et l’on peut observer facilement si elles améliorent le développement du cerveau et/ou atténuent certains comportements chez la larve de poisson zèbre. Les traitements les plus prometteurs peuvent ensuite être testés dans un modèle mammifère comme la souris. En ce sens, les premières évaluations sur les larves de poisson zèbre contribuent à réduire le nombre de mammifères utilisés lors des phases de validation de drogues et donc de se conformer à la règle des 3R.
Pour réduire davantage l’utilisation de la souris, il est aussi possible de poursuivre les analyses sur des modèles organoïdes. Ces modèles in vitro sont développés à partir de cellules humaines obtenues à l’aide de biopsies de peau ou de prélèvements sanguins. Les cellules sont ensuite reprogrammées en cellules souches qui vont s’organiser pour former un organe miniature simplifié, le cerveau ou l’intestin par exemple. Les travaux actuels sur ces organoïdes humains sont très prometteurs. Toutefois, les données acquises sur l’animal restent aujourd’hui essentielles pour caractériser les bases moléculaires des maladies génétiques et identifier des drogues qui pourront, dans l’avenir, intégrer des programmes d’essais thérapeutiques.
Comment vos découvertes se répercutent-elles en définitif sur la prise en charge des patients ?
CG : Ces découvertes impacte positivement la prise en charge des patients et permettent d’améliorer le diagnostic médical. En s’appuyant sur des données fonctionnelles obtenues grâce aux animaux modèles, les praticiens de santé peuvent mieux renseigner les familles sur les causes génétiques de leurs maladies et leur indiquer si des atteintes d’autres organes sont à prévoir comme les atteintes intestinales pour certaines formes d’autisme. Les patients et leurs familles sont ainsi mieux informés et la prise en charge des jeunes patients est améliorée.
Propos recueillis par Anaïs Culot pour le Gircor
Crédits photo : Dr. Marie-Laure Durand
