Un des arguments le plus souvent avancé contre l’expérimentation animale est que les modèles animaux ne peuvent pas garantir l’efficacité et la sécurité d’un médicament destiné à l’Homme. Mais qu’en est-il réellement ? Nous vous expliquons ce qui se cache derrière le chiffre de 90% qui revient régulièrement dans les débats.
Avant tout, il convient de rappeler que le développement d’un médicament est un processus long, complexe et coûteux. Il faut en effet en moyenne 15 ans de recherche et 1,5 milliard d’euros avant de pouvoir mettre un médicament à disposition des patients. Le développement du médicament suit une logique d’entonnoir : chaque étape permet d’éliminer les molécules dangereuses ou inefficaces pour les patients.
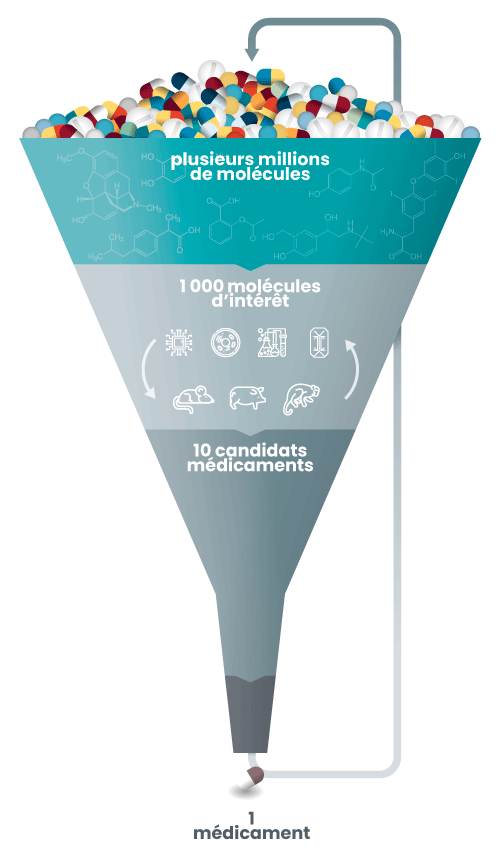
L'identification des molécules
Le haut de l’entonnoir correspond au point de départ du développement d’un médicament.
Les chercheurs utilisent pour cela des bibliothèques de molécules (aussi appelées chimiothèques). Tout comme pour les livres qui sont rangés dans des rayons spécialisés (romans, ouvrages historiques, biographies), des millions de molécules sont ainsi classées en fonction de leur structure et de leur origine (molécules issues de champignons, de plantes, de minéraux…).
Les chercheurs vont alors sélectionner des candidats médicaments, c’est-à-dire des molécules susceptibles d’avoir une action thérapeutique (en fonction de leur forme, leurs propriétés, des données connues sur la maladie à traiter…). Pour cela, ils utilisent des outils informatiques (méthodes in silico), chimiques (méthodes in chemico), et cellulaires (méthodes in vitro).

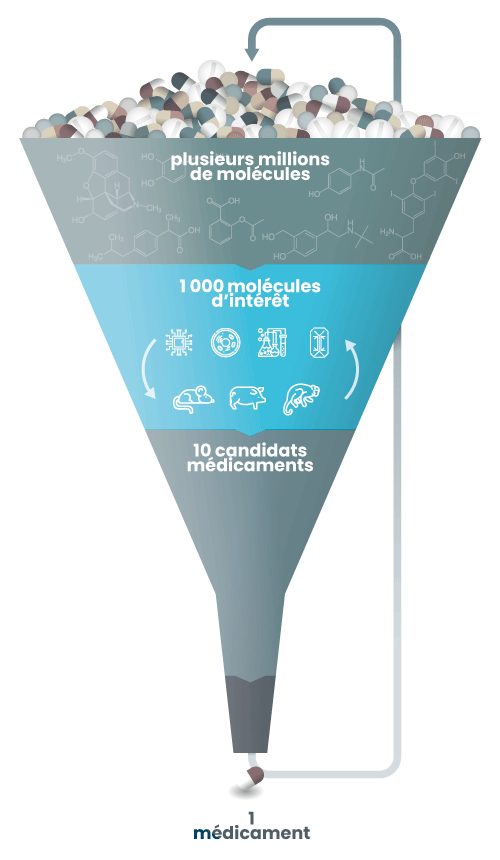
Le développement pré-clinique
Les molécules d’intérêt identifiées seront évaluées sur des modèles de complexité croissante, de la cellule isolée aux organoïdes et aux organes sur puce, et ce jusqu’aux modèles animaux.
À la fin de cette étape, viendront éventuellement les tests chez l’Homme. Avant cela, il est indispensable d’évaluer les candidats médicaments sur un organisme vivant entier. Les effets d’un médicament relèvent en effet de mécanismes extrêmement complexes, qui impliquent la plupart du temps de nombreux organes, interagissant les uns avec les autres. La molécule devra être testée d’abord sur un petit animal (un rongeur généralement) puis sur un gros animal (porc, chien ou singe). Ces tests permettront notamment de déterminer la dose optimale à administrer lors des essais cliniques qui suivront. Toutefois, ce processus n’est pas linéaire, des allers-retours sont nécessaires entre les différents modèles, animaux et non-animaux.
À l’issue de ces derniers tests chez l’animal, 40% des candidats-médicaments sont exclus du processus et ne seront pas testés lors des essais cliniques. Cela démontre clairement l’importance du modèle animal lors de cette phase pré-clinique.

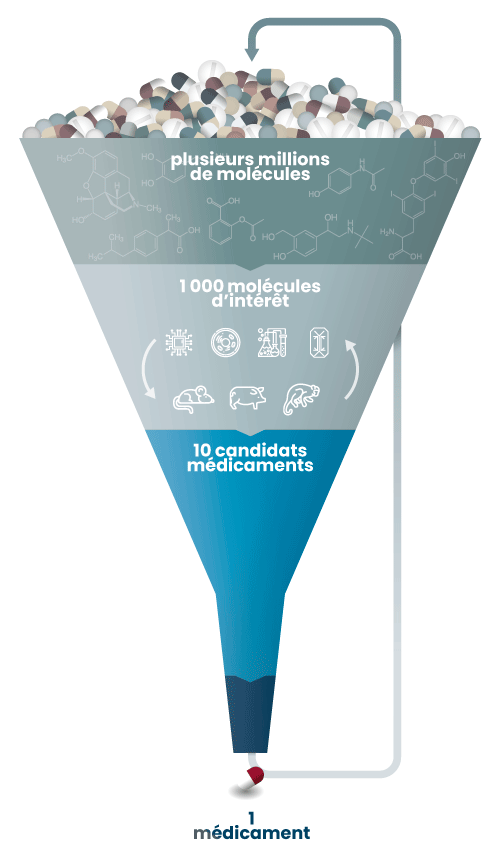
Les essais cliniques
Grâce aux différents modèles utilisés, la grande majorité du millier de molécules testées lors du développement pré-clinique est donc éliminée lors de cette étape en raison de leur inefficacité présumée ou de leur possible dangerosité pour l’Homme. Ce sont généralement moins de 10 molécules qui passent aux essais cliniques.
Ceux-ci se déroulent en 4 phases. Si la phase IV s’intéresse aux effets du médicament sur le long terme une fois mis sur le marché (ce qu’on appelle la pharmacovigilance), les 3 premières viennent en amont de la commercialisation :
- Phase I : évaluation de la tolérance des candidats-médicaments sur des volontaires sains (entre 20 et 100 personnes) ;
- Phase II : évaluation de l’efficacité, observation des potentiels effets secondaires et définition de la posologie sur des patients atteints de la maladie à traiter (entre 40 et 500 patients) ;
- Phase III : évaluation de l’intérêt thérapeutique sur des patients en comparant la molécule avec un placebo ou un traitement de référence (de quelques centaines à plusieurs milliers de patients).
A l’issue de ces 3 phases sur l’Homme :
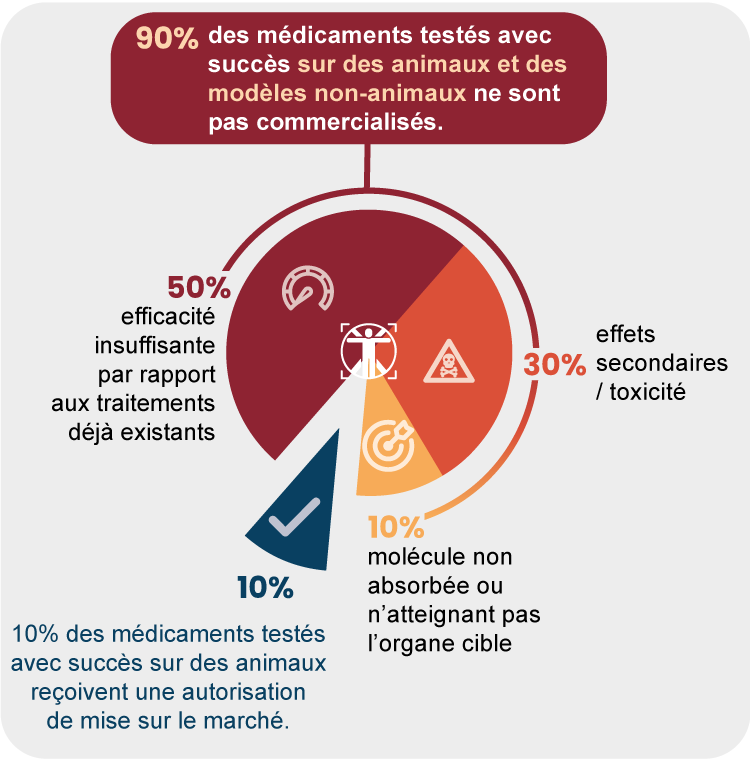
- 50% des molécules testées seront écartées en raison d’une efficacité jugée insuffisante par rapport aux traitements existants (ce qui ne veut pas dire une efficacité nulle) ;
- 30% le seront en raison d’effets secondaires/toxicité jugés trop importants par rapport au bénéfice escompté ;
- 10% le seront parce qu’elles n’ont pas les caractéristiques physico-chimiques leur permettant d’atteindre l’organe cible en concentration suffisamment importante.
En conclusion, il n’est pas juste de dire que 90% des médicaments testés avec succès chez l’animal échouent chez l’Homme, car cela reviendrait à limiter la phase pré-clinique aux seuls tests in vivo (sur animaux). Or la phase pré-clinique intègre aussi bien les tests in vitro, in silico que les tests in vivo (sur animaux) et ces 90% concernent l’ensemble de ces tests.
D’autre part, la notion d’échec doit être relativisée. En effet, plus de la moitié des candidats-médicaments dont le développement s’arrête durant les essais cliniques, présentent une efficacité jugée insuffisante, mais souvent loin d’être nulle. C’est le cas lorsqu’un candidat-médicament ne se démarque pas suffisamment de médicaments déjà commercialisés. Le laboratoire pharmaceutique peut alors décider de renoncer à sa commercialisation.
En conclusion, la prédictivité des modèles utilisés en phase pré-clinique n’est pas parfaite, qu’ils soient animaux ou non.
Néanmoins la contribution des animaux est essentielle puisqu’en fin de phase pré-clinique, ils permettent d’exclure 40% de candidats médicaments, notamment sur la base des risques potentiels chez l’Homme.