Les tumoroïdes constituent un outil précieux en recherche oncologique, offrant un modèle expérimental pertinent pour l’étude des mécanismes du cancer, la recherche et le développement de nouvelles thérapies. À Caen, la plateforme universitaire ORGAPRED est dédiée à la production d’organoïdes tumoraux pour la recherche et la médecine de précision. Nous avons rencontré ses deux responsables, les chercheurs Laurent Poulain et Louis-Bastien Weiswald. Ils nous expliquent les applications des tumoroïdes dans la recherche et leur potentielle utilisation à des fins de médecine personnalisée dans les années à venir.

Pouvez-vous nous présenter votre thématique de recherche et la façon dont vous utilisez des tumoroïdes ?
Laurent Poulain : Nous sommes un groupe spécialisé dans l’étude des cancers de l’ovaire depuis plus de 30 ans au sein de l’unité de recherche Anticipe de l’Inserm. L’objectif de nos travaux est d’améliorer la prise en charge globale de ces maladies. Nos recherches portent à la fois sur l’amélioration de la prédiction des réponses aux traitements anticancéreux et sur le développement de thérapies innovantes. Dans nos différents programmes, nous avons recours à des modèles expérimentaux, dont font partie les organoïdes dérivés de tumeurs que l’on appelle également des tumoroïdes. Ces modèles sont générés par la culture tridimensionnelle de cellules tumorales de patients.
Louis-Bastien Weiswald : Nous les exploitons depuis plusieurs années dans des protocoles visant à confirmer la similarité de réponse des traitements entre les tumoroïdes et les tumeurs d’un patient. Ces recherches, menées sur les cancers des ovaires (protocole clinique OVAREX), ont attiré l’attention de cliniciens qui souhaitaient transposer nos méthodes à des cancers du sein ou des voies aérodigestives par exemple. Afin de répondre à ces demandes, nous avons donc décidé de créer une plateforme dédiée à la culture des tumeurs de patients en tumoroïdes et à leur analyse à haut débit pour contribuer à accélérer la recherche en oncologie en France, la plateforme ORGAPRED.
La plateforme ORGAPRED
accélère la recherche en oncologie

Aller sur le site de la plateforme ORGAPRED
Depuis 2020, la plateforme ORGAPRED est dédiée à la production d’organoïdes tumoraux pour la recherche et la médecine de précision. Rattachée à l’Université de Caen Normandie, elle est la première plateforme en France à faire de la culture et de l’analyse à haut débit.
En 2022, elle obtient le label IBISA qui garantit la qualité de ses activités et sa capacité d’ouverture à la communauté scientifique. Chaque année, elle héberge une trentaine de projets académiques (nationaux et internationaux) sur différents types de cancers (ovaire, sein, côlon, pancréas, etc.). Elle sert aussi de support à des partenariats avec l’industrie et a intégré l’infrastructure de recherche ChemBioFrance en 2023. ORGAPRED est complémentaire à la plateforme OrgaRES de Lille qui est spécialisée dans les organoïdes issus de tumeurs cancéreuses de l’appareil digestif. Enfin, ces deux plateformes font partie du Réseau National de Plateformes de Productions et de Biobanques d’Organoïdes (RIBBON) et du GDR « organoïdes » qui favorisent la diffusion des connaissances sur cette thématique dans la communauté scientifique.
Comment sont conçus les tumoroïdes ?
L-B. W. : Les tumoroïdes sont générés à partir de cellules cancéreuses de patients. Celles-ci sont prélevées sur des pièces opératoires, lors de biopsies ou dans des fluides biologiques (ascite, liquide pleural, etc.). Les cellules cancéreuses sont ensuite isolées et mises en culture dans une matrice extracellulaire (une sorte de gel protéique) en présence d’un milieu de culture dont la composition dépend du type de cancer étudié. Les tumoroïdes se forment entre 2 et 3 semaines et mesurent entre 100 et 300 µm (taille d’un grain de semoule moyen). On peut travailler directement sur les modèles ainsi formés, les dissocier et les repiquer, c’est-à-dire en prélever une partie pour la remettre en culture dans du milieu neuf et établir une « lignée de tumoroïdes », qui peut être maintenue à long terme. On peut enfin les cryo-préserver viables (à -150 °C) afin de les remettre plus tard en culture.
Quelle est la différence entre un tumoroïde et une tumeur ?
L. P. : De la même façon qu’un organoïde n’est pas un organe, un tumoroïde n’est pas une tumeur. Là où un organoïde mime la fonction d’un organe donné, un tumoroïde mime la réponse à un traitement de la tumeur dont il est dérivé. Il ne reproduit cependant pas toute la complexité de cette dernière. En effet, les tumeurs sont des systèmes biologiques vascularisés qui sont également composés de lymphocytes ou encore de fibroblastes – une population de cellules saines très abondantes dans les tumeurs – et on ne retrouve pas ces aspects dans un tumoroïde qui est composé uniquement de cellules cancéreuses.
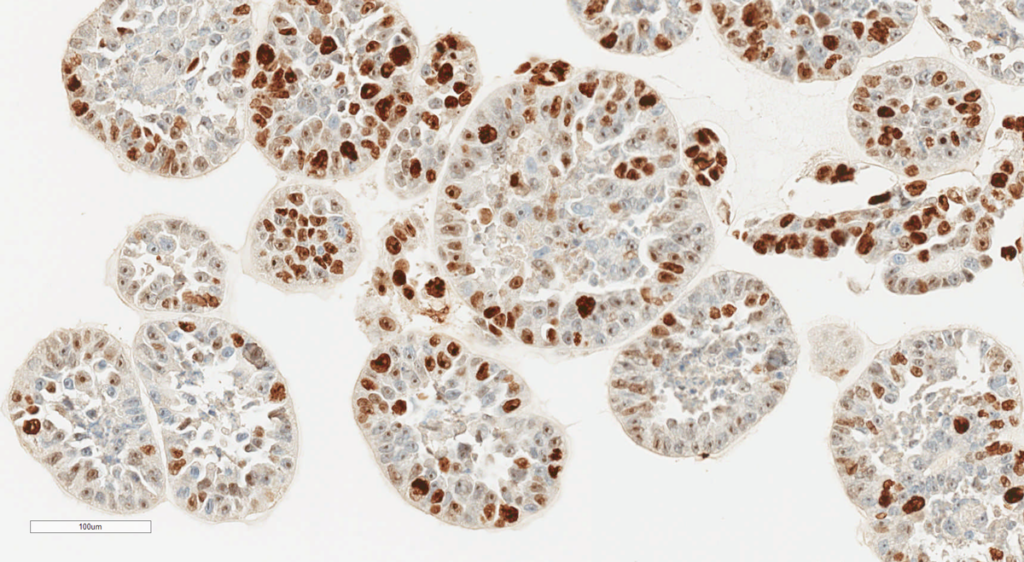
Quelles sont les spécificités des tumoroïdes par rapport à des organoïdes « classiques » ?
L-B. W. : Une importante différence entre les tumoroïdes et les organoïdes (le plus souvent issus de tissus normaux) est la présence d’un biais à la conception. Les tumoroïdes ne représentent que la fraction tumorale dont ils sont issus. Deux prélèvements d’une même tumeur à des endroits différents vont engendrer des tumoroïdes différents du fait de l’hétérogénéité cellulaire des tumeurs.
L. P. : En effet, plus une cellule tumorale est génétiquement instable, plus il y aura une hétérogénéité au fur et à mesure du développement de la tumeur. Sur les tumoroïdes, cela se manifeste par l’obtention de sous-clones qui ne seront peut-être pas représentatifs de la tumeur dans son ensemble. Les réponses des tumoroïdes aux traitements peuvent alors diverger des résultats cliniques du patient. Malgré tout, les expériences montrent en général une bonne corrélation entre les deux, mais il faut être conscient de l’hétérogénéité du matériel utilisé au départ.
Peut-on créer des tumoroïdes de tous types de tumeur ?
L-B. W. : Oui, les laboratoires ont dérivé des tumoroïdes aussi bien de cancer colorectal, du poumon, du pancréas que du sein, de l’ovaire et de la prostate. Toutefois, il est important de noter que le taux d’établissement, c’est-à-dire la proportion de prélèvements à partir desquels il est possible d’obtenir des tumoroïdes, varie d’un cancer à l’autre. Les cancers digestifs ont les taux d’établissement les plus élevés autour de 90 %. Ce taux n’est que de 20 % pour ceux de la prostate et de 50 % pour les cancers ovariens.
L. P : Souvent, il n’est pas possible de mener des analyses susceptibles d’être utilisées en clinique, car les tumoroïdes ne prolifèrent pas en assez grand nombre ou dégénèrent rapidement après leur mise en culture. Pour compenser cela, nos recherches visent à réduire les délais entre le prélèvement et l’analyse à miniaturiser les tests et à les standardiser pour qu’ils puissent être réalisés sur de petites quantités de tumoroïdes de façon fiable.

En quoi consiste cette standardisation ?
L. P. : En pratique, nous obtenons des tumoroïdes de morphologie et de taille variable. L’objectif est d’aboutir à des méthodes calibrées et standardisées. Grâce à elles, nous travaillerons toujours sur le même nombre de tumoroïdes permettant d’apporter un maximum de réponses sur un minimum de matériel. Cela impose d’identifier des seuils critiques : quel est le nombre minimal requis pour obtenir des résultats reproductibles et homogènes ? Quelle doit être la taille des tumoroïdes pour mimer au mieux la réponse de la tumeur d’origine ? Faut-il des mélanges de tumoroïdes de différentes tailles ? etc.
L-B W. : L’enjeu est donc de déterminer les conditions qui seront les mieux corrélées à la réponse clinique du patient et de le reproduire par la suite. Cette étape est incontournable pour que demain ces modèles puissent bénéficier réellement aux patients et que nous puissions intégrer ces technologies dans des essais cliniques fonctionnels.
Les tumoroïdes permettent d’accélérer considérablement
la recherche et le développement de médicaments.
Comment les tumoroïdes sont-ils utilisés par la recherche actuellement ?
L. P. : Ces modèles permettent d’accélérer considérablement la recherche et le développement de médicaments. Ils servent notamment à l’étude des mécanismes de résistance aux traitements mis en place par les cellules tumorales. Ces mécanismes sont complexes et impliquent des changements dans les cellules cancéreuses, comme des modifications génétiques ou métaboliques. Ces changements sont difficiles à observer chez les patients, car cela nécessiterait plusieurs prélèvements au cours de la prise en charge, ce qui n’est pas toujours possible. Au contraire, on peut par exemple étudier l’évolution au cours du temps de tumoroïdes traités par chimiothérapie en vue de leur faire acquérir une chimiorésistance ; ou comparer des tumoroïdes sensibles ou résistants afin d’identifier de nouvelles cibles pour les traitements.
L-B W. : Par ailleurs, avec la plateforme ORGAPRED, nous avons une collection étendue de tumoroïdes qui permet de mener des essais précliniques ex vivo. Autrement dit, on peut tester des molécules chimiques sur un large panel de tumoroïdes de différents cancers et observer les réponses au niveau cellulaire dans les tumoroïdes. Ces modèles peuvent alors aider à trouver de nouveaux traitements pour des types ou des sous-types de cancers spécifiques, à développer de nouvelles molécules médicamenteuses, et même à découvrir de nouvelles utilisations pour des médicaments existants.

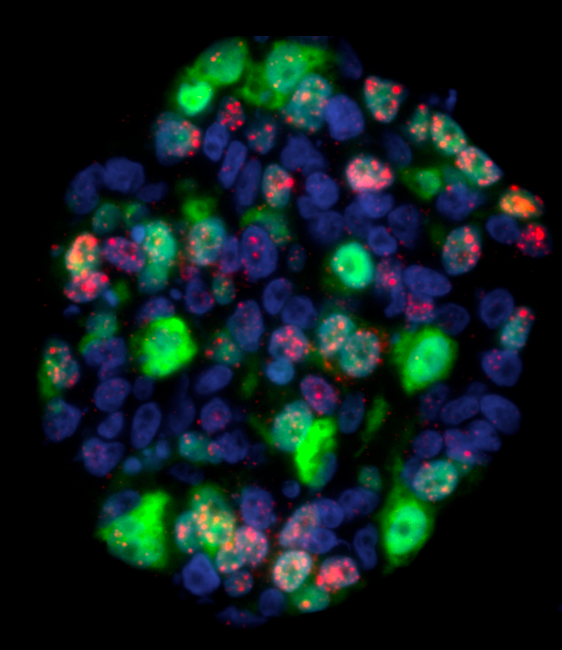
À terme, un des enjeux est de rapprocher ces modèles des patients dans une démarche d’oncologie de précision. Que vont-ils permettent de faire dans ce contexte ?
L. P. : Ce qui nous intéresse en définitive, c’est la prédiction de la réponse au traitement à des fins de médecine personnalisée. Les tumoroïdes peuvent être exposés à tout type de traitement : chimiothérapie, radiothérapie, thérapies ciblées, etc. L’idée serait donc d’utiliser les tumoroïdes à des fins prédictives pour évaluer la réponse d’un patient donné à ces différents traitements en amont de leur usage clinique. Ces tests ex vivo aideraient le clinicien à choisir la stratégie thérapeutique la plus adaptée à son patient. Cependant, le caractère prédictif des tumoroïdes pourrait dépendre des agents anticancéreux utilisés, de leurs dosages, des combinaisons thérapeutiques utilisées. Il reste donc de nombreuses questions à creuser avant de pouvoir les transférer au chevet des patients.
L-B. W. : Des essais cliniques sont en cours afin de déterminer si les tumoroïdes peuvent prédire la réponse aux traitements des patients. En plus d’OVAREX sur les cancers des ovaires, que nous avons déjà mentionné, notre équipe travaille aussi sur les réponses des tumoroïdes des cancers des voies aérodigestives supérieures (protocole ORGAVADS), des cancers du sein triple-négatifs (protocole TRIPLEX) ou encore des cancers de la jonction œsogastrique (protocole GASPAR).

Quels sont les autres modèles couramment utilisés en cancérologie ?
L-B W : Les principaux modèles utilisés sont les lignées cellulaires in vitro qui sont assez éloignées de la situation réelle des tumeurs humaines. Un autre modèle s’appuie sur les xénogreffes dérivées de patients (ou PDX pour Patient-Derived Xenograft). Il consiste à implanter sous la peau de coussinet de souris immunodéprimées des fragments de tumeurs de patients récupérées au bloc opératoire. Ce sont les modèles de référence de l’industrie pharmaceutique, car ils conservent les caractéristiques moléculaires de la tumeur d’origine. Néanmoins, en plus des problèmes éthiques liés au recours aux animaux, ce modèle ne permet pas d’étudier tous les aspects du microenvironnement d’une tumeur, c’est-à-dire les cellules saines qui l’entourent et notamment la composante immunitaire, ce qui limite sa représentativité.
Dans un avenir proche, les tumoroïdes offriront aussi la possibilité d’étudier
les interactions entre la tumeur et son microenvironnement qui jouent un rôle
dans la résistance et le développement des cancers.
Quels sont les avantages des tumoroïdes comparés à ces modèles ?
L-B. W. : Les tumoroïdes offrent, comme les PDX, l’avantage de travailler sur la structuration tridimensionnelle des tumeurs qui est plus représentative de la réalité. Par contre, la temporalité est accélérée. On obtient des modèles tumoroïdes exploitables en quelques semaines contre plusieurs mois pour les PDX. Dans un avenir proche, les tumoroïdes offriront aussi la possibilité d’étudier les interactions entre la tumeur et son microenvironnement qui jouent un rôle dans la résistance et le développement des cancers.
L. P. : Pour le moment, aucun modèle ne permet d’étudier ces interactions de façon complètement satisfaisante. De nombreux travaux sont en cours pour enrichir et complexifier les tumoroïdes grâce à la microfluidique (technologies d’organe et organoïdes sur puce). Cela permettra notamment d’étudier la réponse des tumoroïdes à d’autres traitements comme les immunothérapies qui sont en pleine émergence. C’est vraiment l’avenir des modèles tumoroïdes qui se joue.
Propos recueillis par Anaïs Culot pour le Gircor
Quelques chiffres
- Les tumoroïdes se forment entre 2 à 3 semaines et mesurent entre 100 et 300 µm.
- Il faut compter entre 4 et 8 semaines entre le moment du prélèvement de cellules tumorales chez le patient et l’exploitation de résultats sur les tumoroïdes dérivés.
- Il existe plusieurs plateformes de production et d’analyse d’organoïdes dérivés de tumeurs en France, telles que les plateformes : ORGAPRED (Caen), OrgaRES et Organomics (Lille), 3D-Onco (Lyon), 3D-Hub O et 3D-Hub S (Marseille et Nice).
Cet article a été téléchargé depuis gircor.fr
